Lei de Hess – Como funciona?
A Lei de Hess pode ser considerada uma extensão da Lei da Termodinâmica. Ela afirma que se uma reação pode ocorrer por mais de uma rota a partir das mesmas condições iniciais e finais, então a mudança de entalpia total é a mesma para cada rota.Existem 2 rotas:
A + B + C
Pela Lei De Hess: A + B + C = D
Para exemplificar melhor, confira imagem explicativa abaixo:
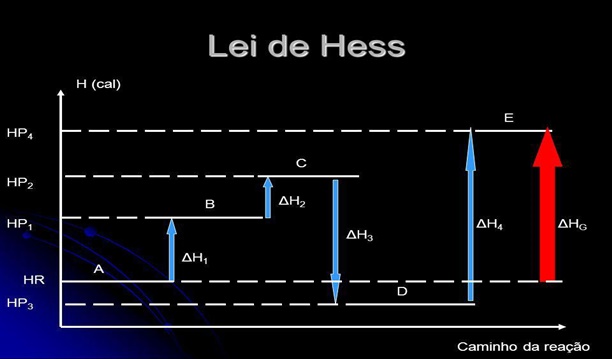
Se 3 dos valores acima são conhecidos então o quarto pode ser trabalhado para fora.
O Ciclo de Hess
Um ciclo de Hess pode ser usado para realizar mudanças de entalpia. Há livros cheios de valores para entalpias de formação para vários compostos.
O que Mais Você Gostaria de Saber?
Escolha abaixo:
Você pode usar a Lei de Hess juntamente com estes valores para trabalhar mudanças de entalpia para muitos tipos de reações.r versão da Lei de Hess é que a mudança de entalpia para uma reação é a soma das entalpias de formação dos produtos, cada uma multiplicada por seu coeficiente correspondente (n) a partir de sua equação química equilibrada, menos a entalpia de formação dos reagentes, cada (novamente) multiplicada por seu coeficiente correspondente.
Adicionar e subtrair várias combinações destas podem facilitar previsões termodinâmicas convenientes para uma grande variedade de reações.
O restante deste artigo trata de como a Lei de Hess é aplicada e generalizada a uma variedade de situações físicas.
História de criação da lei de Hess
A Lei de Hess tem o nome do químico russo Germain Hess. Hess ajudou a formular os primeiros princípios da termoquímica. Seu artigo mais famoso, publicado em 1840, incluía sua lei sobre termoquímica. A lei de Hess é devido à entalpia ser uma função de Estado, que nos permite calcular a mudança geral na entalpia simplesmente somando as mudanças para cada passo do caminho, até que o produto seja formado. Todos os passos têm que prosseguir à mesma temperatura e as equações para os passos individuais devem equilibrar-se. O princípio subjacente à Lei de Hess não se aplica apenas à entalpia e pode ser usado para calcular outras funções, tal como mudanças de energia e de força.
Uma breve explicação sobre as Equações Exponenciais
» Veja dicas de Moda e Beleza exclusivas para você

